알츠하이머병은 전 세계에서 가장 흔한 신경퇴행성 질환이며, 치매 환자의 약 70% 이상을 차지한다.
초기에는 단순한 기억력 저하로 시작되지만, 점차 언어 능력, 판단력, 인격, 행동까지 광범위한 인지기능이 손상되고, 결국 일상생활이 불가능한 상태로 악화된다.
병리학적으로는 아밀로이드 베타의 축적, 타우 단백질의 비정상적 인산화, 신경세포 사멸, 미세아교세포의 염증 반응 등이 복합적으로 관여한다.
이 글에서는 알츠하이머병의 주요 병태생리 기전을 하나씩 짚어보고, 그 기전들이 어떻게 질병 진행에 관여하는지 설명하고자 한다.

AD의 분류: FAD vs SAD
알츠하이머병은 발병 시기와 유전적 원인에 따라 두 가지로 구분된다.
| 발병 시기 | 조기 발병 (주로 30~60세) | 후기 발병 (65세 이후) |
| 유전 양상 | 상염색체 우성 유전 | 다인자성 (복합 유전 + 환경) |
| 주요 유전자 | APP, PSEN1, PSEN2 | APOE ε4 (위험인자), TREM2 등 |
| 발병률 | 전체 알츠하이머병의 1~5% | 전체의 95% 이상 |
| 병리 특징 | Aβ42 과생성, 급속 진행 | Aβ 제거 실패, 병리 다양 |
| 가족력 | 명확한 가족력 존재 | 가족력 없음 또는 불분명 |
| 연구 활용도 | 동물모델 제작에 주로 활용 | 실제 환자 분포에 가까움 |
| 진단 시점 | 비교적 빠른 병기 구분 가능 | 불명확한 병기, 증상 다양 |
두 유형의 병인 기전의 시작점과 조절 메커니즘에 차이가 있지만, 공통적으로 아밀로이드와 타우 병리를 보인다. 이를 염두에 두고 알츠하이머 병의 병태생리 기전을 살펴본다.
1. 콜린성 가설 (Cholinergic Hypothesis)
알츠하이머병 환자에서는 기저 전뇌(basal forebrain, 특히 Meynert 기저핵)의 콜린성 뉴런이 손상되면서 아세틸콜린 생성과 전달이 저하된다. (콜린아세틸트랜스퍼라제(ChAT) 활성 저하, 아세틸콜린(ACh) 생성 감소)
이로 인해 기억 형성, 학습, 집중력에 관여하는 신경회로 기능이 약화되며, 치매 증상이 심화된다.
현재 사용되는 도네페질, 리바스티그민, 갈란타민은 모두 콜린에스테라제(AChE) 억제제이며, ACh 분해를 억제해 증상 완화 효과를 보인다. 그러나 이러한 약물은 병의 진행 자체를 억제하지는 못한다.
- 콜린성 뉴런: 아세틸콜린을 생성하고 방출하는 신경세포
- 아세틸콜린: 기억과 학습에 중요한 역할을 하는 신경전달물질
- 콜린에스테라제: 아세틸콜린을 분해하는 효소
- 콜린에스테라제 억제제: 아세틸콜린 농도를 높여 증상을 완화하는 약물
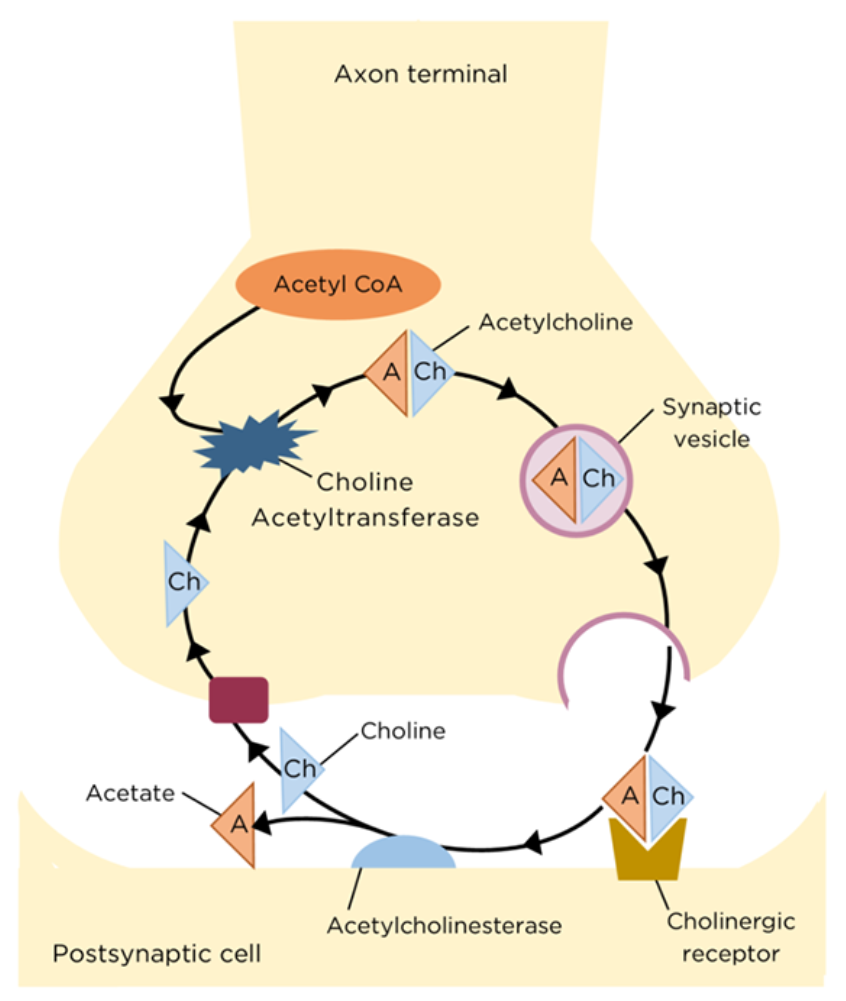
아세틸콜린(ACh)은 콜린과 acetyl-CoA로부터 ChAT에 의해 합성되며, 시냅스 소포(synaptic vesicle)에 저장된다. 신경 신호가 도달하면 ACh가 방출되어 시냅스 후막의 아세틸콜린 수용체에 결합하여 신호를 전달한다. 이후 ACh는 아세틸콜린에스터레이스(AChE)에 의해 분해되고, 콜린은 재흡수된다.
2. 아밀로이드 베타 가설 (Amyloid Hypothesis)
아밀로이드 베타(Aβ)의 축적은 FAD뿐 아니라 SAD 환자 모두에서 관찰되는 주요 병리학적 특징이다. Aβ는 APP(Amyloid Precursor Protein)가 β-secretase(BACE1)와 γ-secretase(PSEN1 또는 PSEN2)에 의해 연속적으로 절단되면서 생성되며, 특히 Aβ40과 Aβ42가 주된 생성 산물이다. 이 중 Aβ42는 소수성이 강해 β-sheet 구조로 전이되며, 응집 및 플라크 형성에 핵심적인 역할을 한다.
- FAD에서는 PSEN1 변이가 γ-secretase의 절단 특성을 변경시켜 Aβ42 비율이 증가
- SAD에서는 Aβ 제거 실패(ApoE ε4 관련)가 축적의 주요 원인

Aβ 축적이 질병을 유도하는 방식은 아직 완전히 합의되지 않았다. 단일체(mononer) 상태의 Aβ는 신경보호 기능을 갖는 것으로 알려져 있으며, 항산화, 항균, 혈관 조절, 시냅스 가소성 강화 등의 역할을 수행한다. 반면, 가용성 Aβ 올리고머는 AD 병리에서 가장 강력한 독성 형태로 간주되며, 다음과 같은 병태생리를 유도한다. :
- 세포막 손상 및 칼슘 항상성 붕괴
- NMDA 수용체 과활성화 → 흥분 독성
- 미토콘드리아 기능 저하 → ATP 고갈, ROS 증가
- 시냅스 가소성 저하 및 장기기억 형성 장애
- 마이크로글리아/아스트로사이트를 통한 염증 유도

아밀로이드 가설은 오랜 시간 알츠하이머병의 병태생리를 설명하는 주류 이론으로 자리해 왔으며,
APP, PSEN1, PSEN2 유전자 돌연변이를 통해 입증된 FAD의 병리 기전은 이 가설을 뒷받침해왔다.
그러나 항-Aβ 치료제들이 반복적으로 인지기능 개선에 실패하면서
Aβ 축적이 병리의 ‘원인’이 아니라 ‘결과’일 수 있다는 관점이 설득력을 얻고 있다.
특히 2006년 Nature에 발표된 Aβ*56 관련 연구가 중심 증거로 인용되어 왔으나, 2022년 이후 해당 논문의 이미지 조작 의혹이 제기되며, 가설의 근거 기반 자체에 대한 재검토가 촉발되기도 했다.
이러한 논의는 아밀로이드 가설의 전체를 부정하기보다, 단일 병인 이론으로는 알츠하이머병의 복합적인 병태를 설명하기 어렵다는 인식에서 비롯된다.
앞으로는 타우 병리, 신경염증, 자가포식, 대사 기능 이상 등과 함께 아밀로이드를 ‘연결 고리 중 하나’로 재위치시키는 방향의 통합적 병리 모델이 요구된다.
- APP(Amyloid Precursor Protein): 세포막을 관통하는 단백질로, 신경세포 표면에서 신경 돌기 성장, 신경세포 간 접착, 축삭 형성 등 다양한 생리적 기능을 수행
- Secretase: APP를 절단하는 효소. β와 γ 두 종류가 있음
- 올리고머: 단백질이 응집되기 전 상태의 작은 집합체. 신경독성이 가장 높다고 알려짐
- NMDA 수용체: 글루탐산 수용체의 일종으로, 과활성 시 칼슘 독성을 유발함
3. 타우 단백질 병리 (Tauopathy)
타우는 뉴런의 축삭에 존재하는 미세소관 안정화 단백질이다.
정상적인 타우는 미세소관에 결합해 세포 내 수송을 지원하지만, 병리적 상황에서는 과인산화되어 다음 병태를 유도한다:
- 과인산화(hyperphosphorylation)로 인해 타우가 미세소관 결합력을 상실 -> 타우 단백질이 미세소관에서 이탈
- 구조적 변화 및 세포 내 잘못된 위치로의 이동 (정상적으로는 축삭에 존재해야 할 타우가 소마(세포체)나 수상돌기로 이동)
- 타우 올리고머(oligomer) 응집 → PHF(Paired Helical Filament) 형성
- PHF가 뭉쳐져 NFT(신경섬유 얽힘, Neurofibrillary Tangles) 형성 → 시냅스 및 뉴런 기능 장애
- 프리온 유사 전파 → 인접 뉴런으로 병리 확산 (주로 시냅스를 통해 전달되며, 새로운 세포에서 타우 응집 유도)
- 세포 독성 증가 → 신경세포 사멸 유도 (시냅스 손상, 미토콘드리아 기능 장애, 자가포식 억제 등이 누적됨)
타우 축적은 인지기능 저하, 뇌 위축, 포도당 대사 저하와 밀접한 상관관계를 보이며, 이는 전형적인 AD뿐 아니라 비전형적 AD 환자에서도 유사하게 관찰된다.
따라서 타우는 AD 병태생리에서 가장 강력한 임상-병리적 상관성을 지닌 인자로 간주되며, 현재는 PET 영상과 혈중 p-tau 바이오마커를 통해 조기 진단 지표로도 활용된다.

4. 신경 염증과 미세아교세포 활성
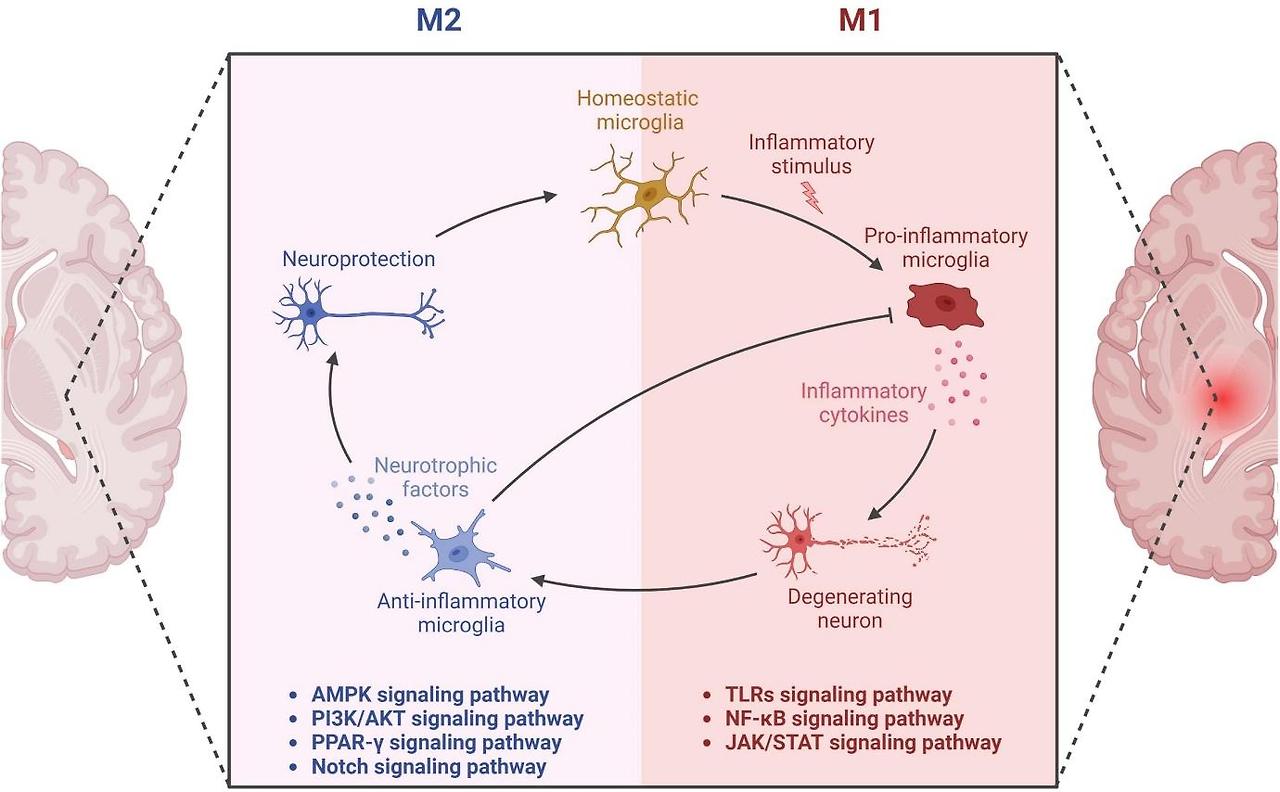
아밀로이드 플라크와 타우 병리는 microglia 및 astrocyte를 만성적으로 자극한다.
초기에는 Aβ 제거를 위한 식세포 역할을 수행하지만, 병리 자극이 지속되면 M1형 염증성 상태로 전환되어 IL-1β, TNF-α 같은 염증성 사이토카인을 분비한다.
이 염증 반응은 주변 신경세포의 2차 손상을 유발하며, 병리 진행을 가속화한다.
특히 TREM2 유전자의 변이는 미세아교세포의 기능 저하 및 병리 단백질 축적과 밀접하게 관련되어 있다.
- Microglia: 뇌의 면역세포로, 손상 감지 및 병리 단백질 제거 기능을 수행함
- 사이토카인: 면역세포가 분비하는 염증 유발 단백질
- TREM2: 미세아교세포의 식세포 기능을 조절하는 수용체로, 유전자 변이 시 알츠하이머병 위험 증가

5. 기타 병태생리 기전
자가포식 이상: 리소좀 기능 저하로 병리 단백질 제거 실패
장-뇌 축(Microbiota-Gut-Brain axis): 장내 미생물총 변화가 염증 및 대사경로에 영향
금속 이온 불균형: Fe, Cu, Zn 등이 Aβ 응집 촉진 또는 ROS 생성에 관여
대사질환 연관: 당뇨, 고지혈증, 비만 등이 인슐린 저항성 → 뇌 인슐린 신호 장애 유발
정리
알츠하이머병은 아밀로이드 중심 모델에서 출발했지만,
현재는 타우 병리, 염증 반응, 면역 조절, 대사 스트레스 등이 복합적으로 작용하는 복합 신경퇴행 질환으로 이해되고 있다.
단일 병인을 겨냥한 치료제는 한계를 보이며, 복합 타깃 기반 치료와 정밀 의료적 접근이 대두되고 있다.
다음 글에서는 이러한 병태생리를 겨냥한 주요 치료제들과 임상적 성과, 그리고 향후 전략을 다룰 예정이다.
'BT > Biotech & Therapeutics' 카테고리의 다른 글
| [알츠하이머병의 이해와 치료제 개발] 2. 알츠하이머병 치료제 – 작용 기전과 임상 성과 정리 (0) | 2025.04.28 |
|---|

댓글